1. Möglichkeiten der NMR-Spektroskopie
- Prinzipiell sind alle Substanzen detektierbar, die mindestens ein nicht-austauschbares Wasserstoffatom im Molekül aufweisen.
- Voraussetzung für eine Messung ist eine klare, flüssige und homogene Probe. Die NMR-Spektroskopie ist daher auf alle flüssigen oder in einem geeigneten Lösungsmittel löslichen Matrices anwendbar. Beispielsweise kann Wein ebenso gut wie Öl oder eine Brausetablette untersucht werden.
- Bei wässrigen Proben wird eine Probenmenge von mindestens 30 ml benötigt.
- Für eine quantitative Auswertung ist die Kenntnis der möglichen Inhaltsstoffe nötig, um mögliche Störungen von Signalen zu erkennen und zu berücksichtigen.
- Ein Vergleich zweier (oder mehrerer Proben) auf deren Identität ist aus ohne vorherige Kenntnis der Inhaltsstoffe möglich.
- Wein enthält ca. 150 detektierbare Substanzen. Davon können bisher etwa 70 Substanzen gleichzeitig quantifiziert werden.
- Die Nachweisgrenzen liegen je nach Parameter bei < 1 mg/l.
- Im Vergleich zu den meisten anderen Analysenmethoden deckt die NMR-Spektroskopie mit einer Messung einen sehr großen Messbereich von 1 mg/l bis zu über 100 g/l ab.
- Neben dem Probenvergleich und der quantitativen Analyse ist auch eine metabolomische Auswertung der Spektren mittels multivariater Statistik möglich. Somit können beispielsweise Rebsorten und Herkunft ermittelt werden.
2. Messergebnisse und Auswertung der Spektren
Die Möglichkeiten der NMR-Analyse werden im Folgenden an der komplexen Matrix Wein erläutert, lassen sich jedoch auf andere Matrices wie beispielsweise Obst- und Gemüsesäfte, Bier, Spirituosen, Mischgetränke, Essig und auch Speiseöle übertragen.
In Abbildung 1 ist das gesamte Spektrum eines Weins gezeigt zusammen mit der Zuordnung einiger Signale zu den entsprechenden Parametern. In dieser Darstellung ist das Spektrum jedoch aufgrund seiner hohen Komplexität nicht auswertbar. Wein liefert ein Spektrum mit ca. 1000 Signalen bzw. Signalteilen, die in dieser Vergrößerung nicht sichtbar sind.
Vergrößert man beispielsweise einen sehr kleinen Bereich des Spektrums, der nur 1,5% des gesamten Spektrums zeigt (s. Abbildung 2), so wird ersichtlich, dass es sich um ein hoch aufgelöstes Spektrum handelt.
Für die Quantifizierung werden geeignete Signalflächen verwendet, da diese proportional zur Konzentration sind.

Abbildung 2: Ausschnitt aus dem Gesamtspektrum eines Weins mit BEschriftung der Signale von Zitronen- und Äpfelsäure
3. Identitätskontrolle – Vergleich von Proben
-
- Diese Methode liefert schnell und kostengünstig produkteigene spektrale Fingerabdrücke und ist somit eine ideale Screening Methode um z.B. untypische Komponenten in einem Chargenvergleich oder einem Vergleich von Halb- und Fertigware (z.B. Fass- und Flaschenmustern) vorläufig zu identifizieren.
- Da jede Substanz ein sehr spezifisches Muster an Signalen hervorruft und diese sich in der Probe prozentual zur Konzentration der Substanz der Substanz in der Probe überlagern, ergibt sich für jede Probe ein Spektrum, das ähnlich einem Fingerabdruck eine Aussage über die Identität zweier Proben zulässt. Obwohl eigentlich drei Kurven gezeigt werden, liegen diese so exakt übereinander, dass praktisch nur ein Spektrum zu sehen ist. Ist dies für das gesamte Spektrum der Fall können die Proben als identisch angesehen werden.
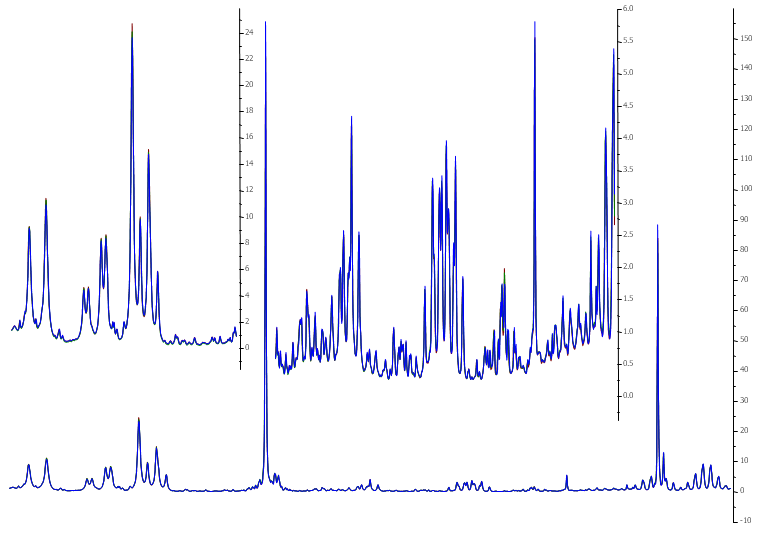
Abbildung 3: Identitätsprüfung dreier Weißweine. Die Spektren sind so genau überlagert, dass die rote und die grüne Linie nicht zu erkennen sind.
-
- Daher sind zur besseren Sichtbarkeit der drei Spektren in Abbildung 4 in der vertikalen Achse auseinander gezogen.
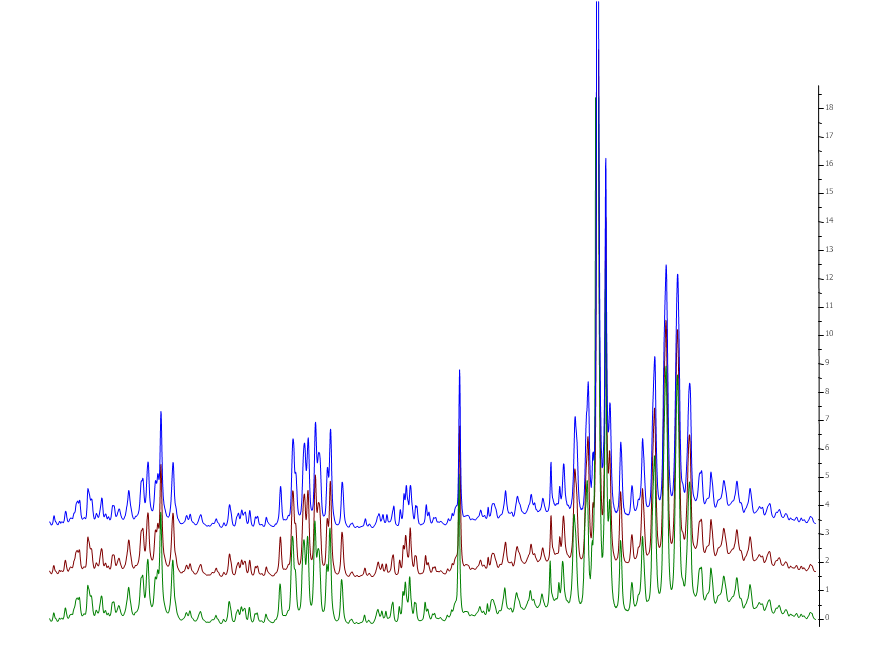
Abbildung 4: Ausschnitt aus der Überlagerung der drei Weißwein-Spektren. Zur besseren Sichtbarkeit sind die 3 Spektren in der vertikalen Achse auseinander gezogen.
-
- Als weiteres Beispiel dienen zwei Sherry-Proben, die sich sensorisch unterscheiden. Obwohl die Konzentrationen vieler Inhaltsstoffe nahezu identisch sind (siehe dazu beispielsweise Abbildung 5), können mit Hilfe der NMR-Spektroskopie auch Unterschiede manifestiert werden, die durch nicht näher identifizierte Substanzen (siehe Abbildung 6) zurückgeführt werden können. Die NMR-Spektroskopie ist damit im Vorteil gegenüber einer zielgerichteten Analysenmethode, die nur die Konzentrationen bekannter Substanzen erfassen kann.

Abbildung 5: Vergleich zweier Sherry-Proben. In diesem Bereich des Spektrums zeigen sich keine signifikanten Unterschiede zwischen den beiden Proben.

Abbildung 6: Vergleich zweier Sherry-Proben. Die eine Probe (blaues Spektrum) weist eine deutlich höhere Konzentration einer Substanz auf als die der Vergleichsprobe.
4. Quantitative Analyse
Der Umfang der quantitativen Analyse wird am Beispiel von Wein dargestellt. Für andere Matrices können entsprechende Parameter ergänzt und/oder ausgelassen werden. Derzeit können im Wein ca. 70 Parameter bestimmt werden. Ein reduzierter Analysenumfang umfasst folgende Parameter:
- Zucker (Glucose, Fruktose, Saccharose)
- Alkohole & andere Gärungsprodukte (Ethanol, Glycerin, Methanol, Acetaldehyd (frei & SO2 gebunden), Acetoin, 1,3Propandiol, Ethylacetat, Tyrosol)
- organische Säuren (Weinsäure, Äpfelsäure, Shikimisäure, Milchsäure, Essigsäure, Zitronensäure, Bernsteinsäure, Fumarsäure, Ascorbinsäure, Ameisensäure, Galacturonsäure, Gluconsäure)
- Konservierungsmittel (Sorbinsäure, Benzoesäure, Salicylsäure)
- Aminosäuren (Prolin)
- Phenole (Catechin, Epicatechin)
- weitere Inhaltsstoffe (HMF, Furfural)
Zur Veranschaulichung der Aussagekraft einer NMR-Analyse werden im Folgenden die Bedeutungen der oben genannten Parameter erläutert und beispielhaft mit Spektrenausschnitten erläutert. Sofern nicht explizit erwähnt handelt es sich um die Bedeutung des Parameters im Wein.
Für eine Auflistung aller momentan verfügbaren Parameter und deren Nachweis- und Bestimmungsgrenzen, schreiben Sie bitte eine E-Mail an info [at] institut-heidger[.]de. Gerne informieren wir Sie auch über die Möglichkeiten der NMR-Analyse in anderen Matrices.
4.1 Zucker
-
- Glucose und Fruktose sind die mengenmäßig am meisten vorkommenden und damit wichtigsten Zucker im Wein. Ihr Verhältnis ist abhängig von den verwendeten Hefen.
- Aufgrund der Reglementierung der Saccharosezugabe bietet die NMR-Analyse durch die geringe Nachweisgrenze eine sehr gute Möglichkeit zur Kontrolle dieses Parameters.

Abbildung 7: Darstellung der Signale von Glucose und Fruktose. Die blaue Linie zeigt jeweils das Originalspektrum, die schwarzen Kurven sind mathematische Fit-Funktionen, die in der Summe das Originalspektrum widerspiegeln und die zur Quantifizierung verwendet werden.

Abbildung 8: Saccharosesignal in einem Schaumwein. Die blaue Linie zeigt jeweils das Originalspektrum, die schwarzen Kurven sind mathematische Fit-Funktionen, die in der Summe das Originalspektrum widerspiegeln und die zur Quantifizierung verwendet werden.
4.2 Alkohole & andere Gärungsprodukte
-
- Im Saft ist der Nachweis von Ethanol im Spurenbereich möglich, so dass eine beginnende Vergärung der Früchte oder des Safts kontrolliert werden kann.
- Der Methanolgehalt muss zur Überprüfung der Einhaltung der Grenzwerte kontrolliert werden.

Abbildung 9: Darstellung der Signale von Ethanol im Spurenbereich im Saft und Methanol im Wein. Die blaue Linie zeigt jeweils das Originalspektrum, die schwarzen Kurven sind mathematische Fit-Funktionen, die in der Summe das Originalspektrum widerspiegeln und die zur Quantifizierung verwendet werden.
-
- Zudem wird der natürliche Gehalt an Glycerin untersucht.
- Auch ein Inhaltsstoff wie beispielsweise Tyrosol, das in Weinen einen Geruch nach Honig oder einen leicht bitteren Nachgeschmack hervorrufen kann und mit Konzentrationen um 15 mg/l auftritt, kann neben anderen Inhaltsstoffen, die in der Größenordnung von >100 g/l vorkommen, problemlos nachgewiesen werden.

Abbildung 10: Darstellung der Signale von Glycerin und Tyrosol. Die blaue Linie zeigt jeweils das Originalspektrum, die schwarzen Kurven sind mathematische Fit-Funktionen, die in der Summe das Originalspektrum widerspiegeln und die zur Quantifizierung verwendet werden.
- Acetoin als Produkt des hefestoffwechseln führt zu einem buttrigen Geruch und kann in Konzentrationen > 5 mg/l nachgewiesen werden.
- 1,3-Propandiol ist ein Abbauprodukt des Glycerins. Zur genaueren Erläuterung der Bedeutung dieses Parameters sei auf Abschnitt 1 verwiesen.
- Schließlich kann auch 3-Methylbutan-1-ol als Produkt des Hefestoffwechsels nachgewiesen werden.
4.3 Organische Säuren
-
- Weinsäure kann im Saft bereits in geringen Konzentrationen nachgewiesen werden und somit eine Zugabe von Traubensaft anzeigen. Dementsprechend ist die Bestimmung im Wein problemlos möglich.
- Die Konzentration von Äpfelsäure dient zur Bewertung des biologischen Säureabbaus.
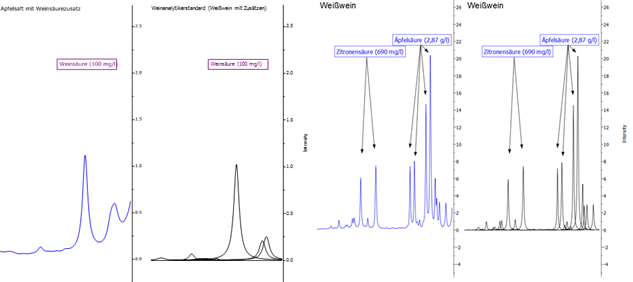
Abbildung 11: Darstellung der Signale von Weinsäure und Äpfelsäure. Die blaue Linie zeigt jeweils das Originalspektrum, die schwarzen Kurven sind mathematische Fit-Funktionen, die in der Summe das Originalspektrum widerspiegeln und die zur Quantifizierung verwendet werden.
-
- Rebsorten können anhand der der Konzentration an Shikimisäure in gewissem Maße identifiziert werden.
- Essigsäure entsteht durch mikrobiellen Verderb und wird daher überwacht. Die Grenzwerte für Weißwein und Rotwein liegen bei 1,0 bzw. 1,2 g/l.

Abbildung 12: Darstellung der Signale von Shikimisäure und Essigsäure. Die blaue Linie zeigt jeweils das Originalspektrum, die schwarzen Kurven sind mathematische Fit-Funktionen, die in der Summe das Originalspektrum widerspiegeln und die zur Quantifizierung verwendet werden.
-
- Konzentrationen an Milchsäure > 0,1 g/l werden als Indiz für bakteriellen Äpfelsäureabbau angesehen.
- Die Konzentration an Zitronensäure ist gesetzlich auf Werte < 1,0 g/l festgelegt.

Abbildung 13: Darstellung der Signale von Milchsäure und Zitronensäure. Die blaue Linie zeigt jeweils das Originalspektrum, die schwarzen Kurven sind mathematische Fit-Funktionen, die in der Summe das Originalspektrum wiederspiegeln und die zur Quantifizierung verwendet werden.
-
- Neben Essigsäure ist Ameisensäure die zweitwichtigste Komponente der flüchtigen Säure. Ameisensäure kommt jedoch nur in Spuren vor und kann ab 0,5 mg/l nachgewiesen werden.
- Der Gehalt an Fumarsäure ist auf maximal 1 g/l begrenzt.

Abbildung 14: Darstellung der Signale von Ameisensäure und Fumarsäure. Die blaue Linie zeigt jeweils das Originalspektrum, die schwarzen Kurven sind mathematische Fit-Funktionen, die in der Summe das Originalspektrum widerspiegeln und die zur Quantifizierung verwendet werden.
- Zudem kann Ascorbinsäure, die als Zusatz zur UTA-Vermeidung eingesetzt wird, quantitativ bestimmt werden.
- Bernsteinsäure ist ein Nebenprodukt der alkoholischen Gärung, das aus abgebauter Äpfelsäure und vermutlich auch aus Glutaminsäure und Asparaginsäure entsteht. Eine erhöhte Konzentration weist auf den Befall der Trauben mit Botrytis cinerea hin.
4.4 Konservierungsmittel
-
- Sorbinsäure wird in Konzentrationen bis 200 mg/l gegen Hefen und Schimmelpilze eingesetzt. Sorbinsäure wirkt jedoch kaum gegen Essig- und Milchsäurebakterien.
- Der unerlaubte Einsatz von Benzoesäure kann mittels NMR eindeutig nachgewiesen werden.
- Salicylsäure kommt in geringen Mengen natürlich vor, höhere Konzentrationen sind jedoch ein Hinweis auf den nicht erlaubten Zusatz von Salicylsäure. Ihre Konservierungswirkung ist ähnlich der Sorbinsäure.
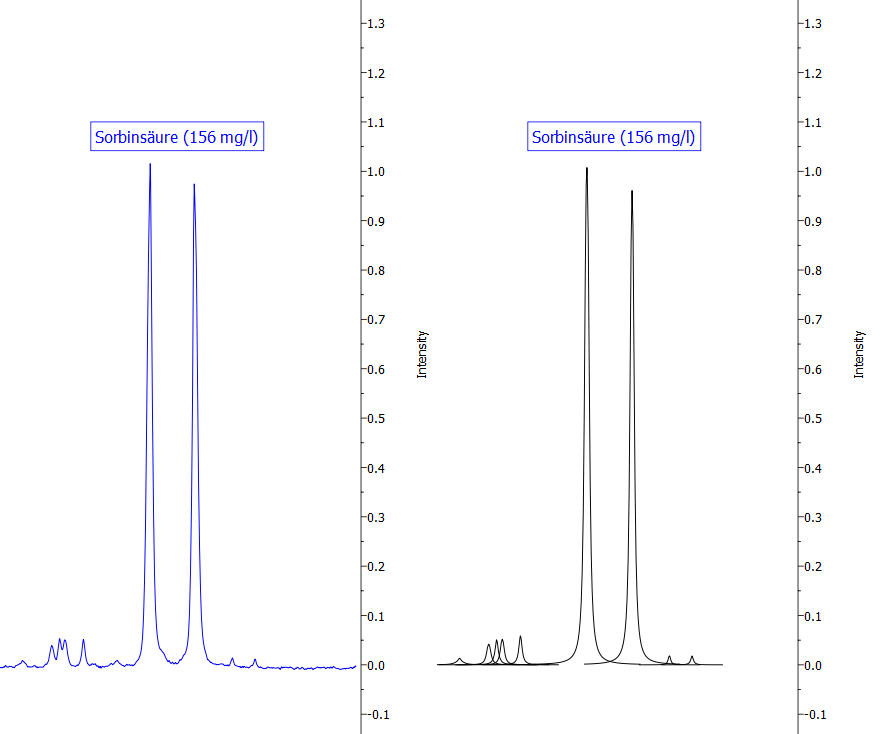
Abbildung 15: Darstellung eines Signals von Sorbinsäure. Die blaue Linie zeigt das Originalspektrum, die schwarzen Kurven sind mathematische Fit-Funktionen, die in der Summe das Originalspektrum widerspiegeln und die zur Quantifizierung verwendet werden.
4.5 Aminosäuren
- Prolin ist eine Aminosäure, die keine Stickstoffquelle für Hefen und Bakterien ist. Da die Konzentration stark klimaabhängig ist, kann sie als Reifemarker und Herkunftsindikator verwendet werden.
4.6 Phenole
- Catechin und Epicatechin liefern einen signifikanten Beitrag zum Gesamtphenolgehalt. Ihre Konzentrationen werden durch die Kontaktzeit von Schalen und Saft mitbestimmt und haben einen Einfluss auf die Farbe von Rotweinen.
4.7 Weitere Inhaltsstoffe
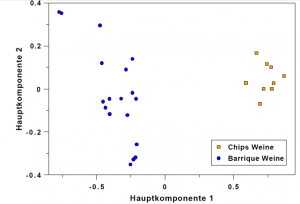
- HMF (Hydroxymethylfurfural) entsteht durch das Räuchern von Holz und kann zur Unterscheidung der Verwendung von Barrique-Fässern oder Chips verwendet werden. Bei Getränken, die erhitzt wurden steht die Konzentration im Zusammenhang mit Dauer und Temperatur der Erwärmung.
- Furfural ist ein Marker für die Barrique-Lagerung und ein charakteristischer Inhaltsstoff in gealterten Rieslingen.
5. Beurteilung
Neben dem Probenvergleich und der quantitativen Analyse bestimmter Parameter bietet das NMR-Spektrum die Möglichkeit Veränderungen und Abnormitäten von Produkten zu erkennen.
5.1 Verderbnisnachweis – Rotwein mit Essignote und geringem Glyceringehalt
Eine Probe wurde wegen eines zu hohen Gehalts an Essigsäure (1,4 g/l), die auch sensorisch wahrnehmbar war, beanstandet (Überschreitung des Grenzwerts). Die daraufhin erstellte NMR-Analyse zeigte eine atypische geringe Konzentration an Glycerin von 2,3 g/l und eine äußerst hohe Konzentration von 1,3-Propandiol (3,3 g/l). In der Tabelle sind Vergleichswerte zu einem verkehrsfähigen Wein enthalten.
| Probe | Vergleich | |
| Essigsäure | 1,4 g/l | 0,4 g/l |
| Glycerin | 2,3 g/l | 6,5 g/l |
| 1,3-Propandiol | 3,3 g/l | 0,2 g/l |
Die Suche nach Auffälligkeiten im Spektrum lässt einen Schluss auf den bakteriellen Glycerinabbau zu 1,3-Propandiol zu, der mit Fachliteratur belegt werden konnte: “Eine biochemische Synthese (Anm. von 1,3-Propandiol) kann durch die Vergärung von Glycerin durch Bakterien der Gattung Citrobacter, Clostridium und Aerobacter bewerkstelligt werden.”[1]
Die NMR-Analyse bietet somit Vorteile, da Auffälligkeiten von Weinen aufgrund der Vielzahl an nachweisbaren Substanzen besser erkannt werden können. Zudem besteht die Möglichkeit auch im Nachhinein (auch ohne das Vorhandensein weiterer Probe) noch eine erweiterte Auswertung vorzunehmen, die nicht im ursprünglichen Analysenumfang enthalten war.
[1] Zitat von http://de.wikipedia.org/wiki/1,3-Propandiol, mit Literaturverweis auf C. H. Werkman, G. F. Gillen: Bacteria Producing Trimethylene Glycol, in: J. Bacteriol., 1932, 23, S. 167–182.)

Abbildung 16: Ausschnitte aus dem Vergleich zweier Weine. Die Probe mit dem zu hohen Gehalt an Essigsäure (rote Linie) weist eine deutlich geringere Konzentration an Glycerin auf, die mit einer fast stöchiometischen Zunahme an 1,3-Propandiol einhergeht.
5.2 Botrytisbefall der Trauben – Einfluss auf den Wein
Charakteristika durch Botrytisbefall wurden in Traubenmost und Wein untersucht. Als Beispiele wurden Grauburgunder- und Rieslingtrauben gewählt.
Schon der erste Blick auf einen Spektrenausschnitt (s. Abbildung 18) zeigt deutliche Unterscheide zwischen den beiden Spektren. Auch ohne eine Zuordnung jedes einzelnen Unterschieds zu einer Substanz, werden die Möglichkeiten, die sich aus dem NMR-Spektrum ergeben, bereits deutlich.

Abbildung 18: Ausschnitt aus dem Vergleich von Saft der Trauben ohne (blaue Linien) und mit (rote Linien) Botrytisbefall.
Die folgenden Abbildungen zeigen beispielhaft die Unterschiede in Most (jeweils links) und Wein (jeweils rechts) die sich aus dem Botrytisbefall der Trauben ergeben. Die rot gefärbten Spektren zeigen jeweils die Proben mit Botrytisbefall; die blau gezeichneten Spektren gehören zu den Proben ohne Botrytisbefall. Eine Interpretation des Ergebnisses ist jeweils in der Bildunterschrift enthalten.
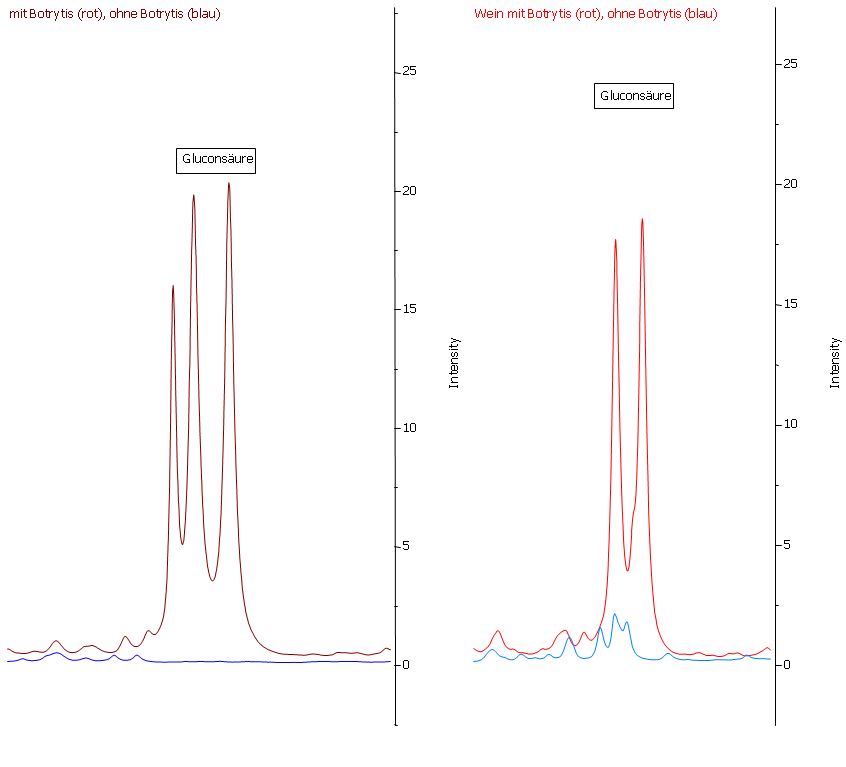
Abbildung 19: Gluconsäure im Most (links) und im Wein (rechts). Gluconsäure ist ein ausgezeichneter Marker für Botrytisbefall. Im Most der gesunden Trauben (blaue Linie) ist keine Gluconsäure nachweisbar. Im Most der faulen Trauben (rote Linie) liegt eine sehr hohe Konzentration vor. Durch die Gärung wird weder Gluconsäure abgebaut noch entsteht diese.
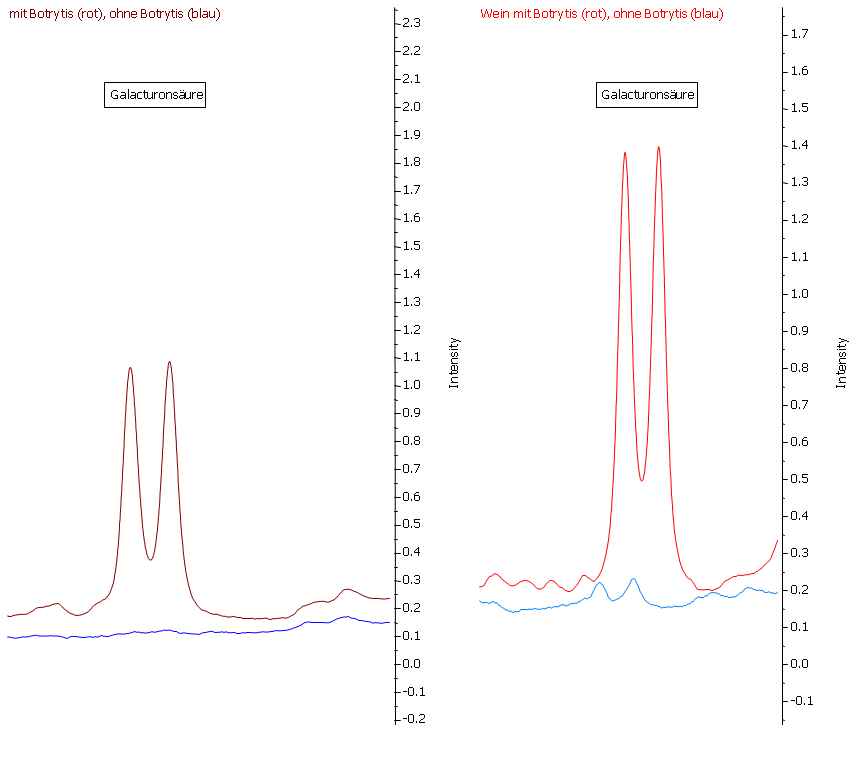
Abbildung 20: Ebenso ist die Galacturonsäure ein sehr guter Parameter zur Beurteilung des Botrytisbefalls. Nur im Most (links) der faulen Trauben (rote Linie) ist Galacturonsäure nachweisbar, die gesunden Trauben (blaue Linie) enthalten keine nachweisbaren Mengen an Galacturonsäure. Durch die Gärung findet nahezu keine Beeinflussung der Galacturonsäure-Konzentration statt.
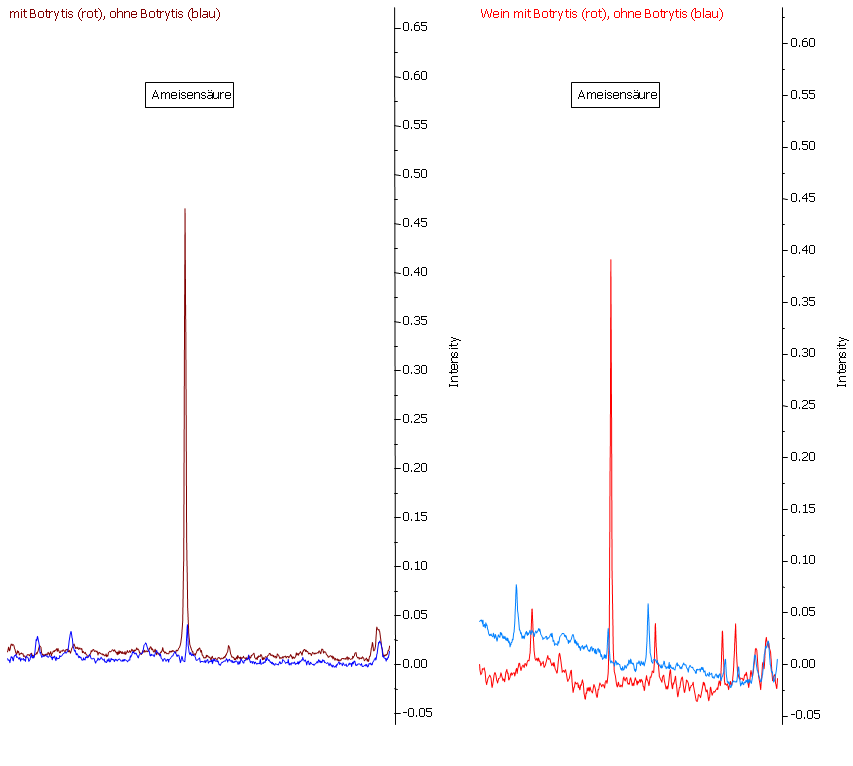
Abbildung 21: Ameisensäure ist zwar auch im Most (links) der gesunden Trauben (blaue Linie) nachweisbar, aber nur in sehr geringen Mengen. Durch den Botrytisbefall wird Ameisensäure in wesentlich höherer Konzentration nachgewiesen. Vergleicht man dies nun mit den vergorenen Produkten (rechts), so wurden die Konzentrationen an Ameisensäure nicht durch die Gärung beeinflusst.

Abbildung 22: Vergleicht man nur die beiden Moste (links) miteinander, so verhält sich die Bernsteinsäure ähnlich der Ameisensäure – sie ist zwar auch im Saft der gesunden Trauben nachweisbar, aber ihre Konzentration wird durch Botrytisbefall um ein Vielfaches erhöht. Hier spielt es eine Rolle die Spektren vor und nach der Gärung zu betrachten, da Bernsteinsäure unabhängig vom Befall der Trauben mit Botrytis cinerea während der Gärung gebildet wird. Der Konzentrationsunterschied ist zwar auch noch nach der Gärung noch deutlich sichtbar, es wird jedoch viel schwieriger sein nur anhand dieses einen Parameters eine fundierte Aussage über den Botrytisbefall der Trauben zu treffen. An dieser Stelle zeigt sich deutlich, dass es die Vielzahl und die Bandbreite der Parameter sind, die die NMR-Analyse so aussagekräftig machen.
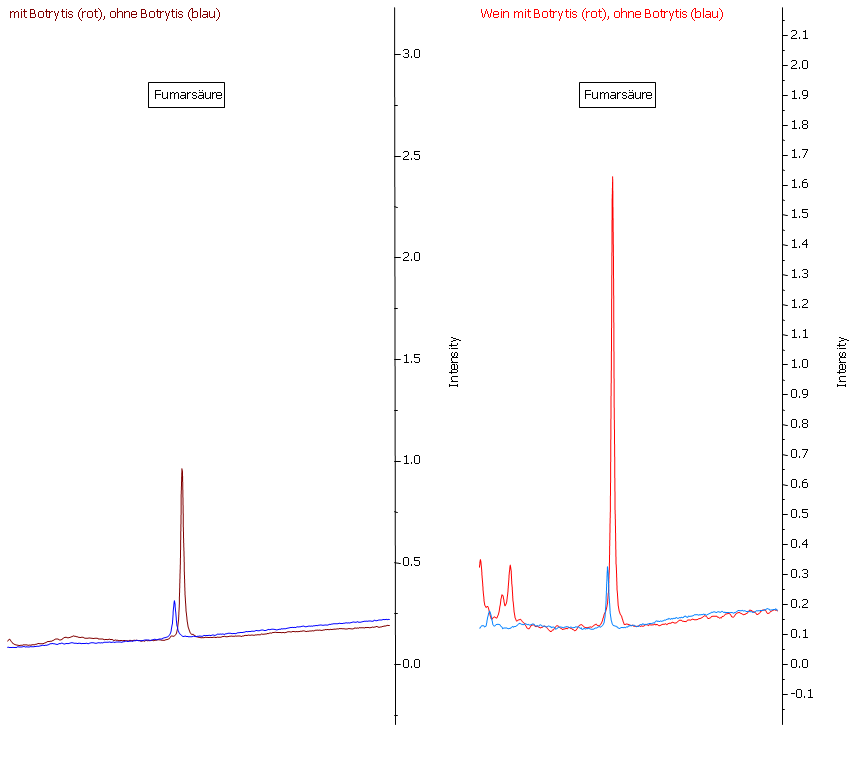
Abbildung 23: Fumarsäure ist zwar auch im Most (links) gesunder Trauben (blaue Linie) nachweisbar, ihre Konzentration ist jedoch bei Botrytis-Befall um ein Vielfaches erhöht. Durch die Gärung findet nur eine unwesentliche Beeinflussung der Konzentration statt.
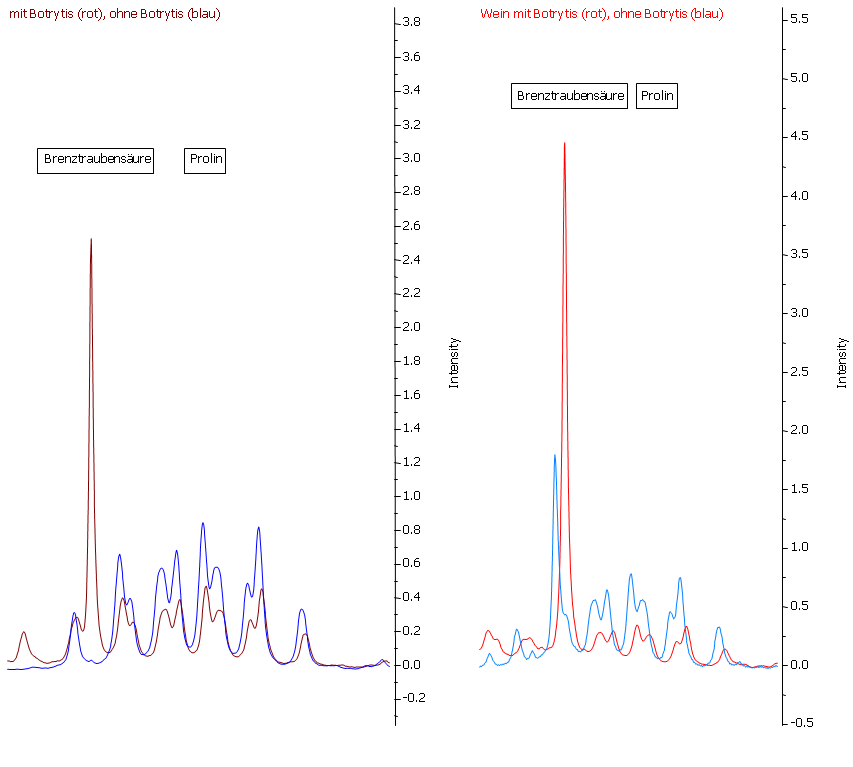
Abbildung 24: Brenztraubensäure und Prolin. Im Most der gesunden Trauben ist im Gegensatz zu den botrytis-befallenen keine Brenztraubensäure nachweisbar. Während der Gärung entsteht in beiden Fällen weitere Brenztraubensäure. So ist Brenztraubensäure ein ebenso von der Fäulnis wie von der Gärung abhängiger Parameter. Prolin kann durch Botrytisbefall in verringerter Konzentration vorliegen, wird jedoch nicht mehr durch die Gärung beeinflusst. Da Prolin jedoch auch von den klimatischen Bedingungen abhängig ist, kann es nicht als Marker für Botrytisbefall verwendet werden. Will man jedoch den Prolingehalt als Reifemarker verwenden, so ist zu berücksichtigen, dass die Prolin-Konzentration durch eventuellen Botrytisbefall verringert sein kann.
6. Statistische Auswertung der Proben
- Da die Mischung der detektierbaren Substanzen, wie zuvor erläutert, zu einem Spektrum führt, das wie ein Fingerabdruck die Probe eindeutig identifiziert, können aus diesem „Fingerabdruck“ mittels statistischer Methoden Aussagen bezüglich folgender Kategorien über die Proben getroffen werden:
-
- Rebsorte:
-
- Dazu werden nach den Methoden multivariater Statistik die zu untersuchenden Proben mit den in einer Datenbank abgelegten Vergleichsproben verglichen. Die entsprechenden Datenbanken dazu befinden sich im Aufbau.
7. Ausblick und Zusammenfassung
- Neben Wein können fast alle klaren Flüssigkeiten mittels NMR-Spektroskopie untersucht werden.
- Trübe Proben müssen bei der Probenvorbereitung filtriert oder zentrifugiert werden.
- CO2-haltige werden vor der Messung entgast.
- Bisher wurden neben Wein auch
- Essig,
- Saft,
- Spirituosen,
- Bier und
- spezielle wässrige Lösungen oder Reaktionsmischungen untersucht.
- Desweiteren können in Zukunft aber auch
- Olivenöl und
- andere Speiseöle mittels NMR-Spektroskopie untersucht werden.
- Feststoffe, wie beispielsweise Brausetabletten, können in einem geeigneten Lösungsmittel gelöst und anschließend gemessen werden.
- Ein Vergleich zweier Proben auf Identität kann ohne die vorherige Kenntnis der möglichen Inhaltsstoffe durchgeführt werden.
- Quantifizierungen bedürfen der vorherigen Recherche/Kenntnis möglicher Inhaltsstoffe und deren zu erwartender Konzentrationen.
- Eine statistische Auswertung, wie sie beispielsweise einer Rebsortenuntersuchung zugrunde liegt, erfordert sowohl die Kenntnis möglicher Inhaltsstoffe als auch eine große Anzahl an gemessenen Vergleichsproben.